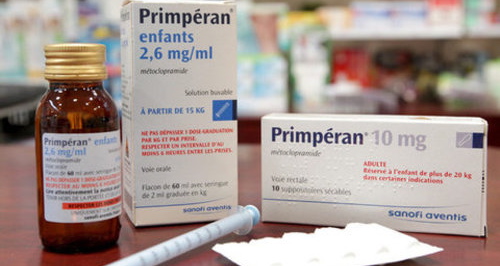
 Le Primpéran, maintenant, c'est plus pour les enfants
Le célèbre médicament anti-nausées et anti-vomissements vient en urgence d’être interdit en France à tous les moins de dix-huit ans, après près d'un demi-siècle de commercialisation. Une nouvelle décision quasi-incompréhensible de l’Afssap.
Le Primpéran, maintenant, c'est plus pour les enfants
Le célèbre médicament anti-nausées et anti-vomissements vient en urgence d’être interdit en France à tous les moins de dix-huit ans, après près d'un demi-siècle de commercialisation. Une nouvelle décision quasi-incompréhensible de l’Afssap.
Vous avez tous connu, enfant, les joies des cuillerées de Primpéran. Puis il y eut pire: fort d’une ordonnance, vous avez un beau jour contraint votre enfant à en prendre. C’est fini. Le cercle médicamenteux pédiatrique est brisé, l’heure est venue d’informer l’opinion: le Primpéran n’était rien d’autre qu’un médicament neuroleptique (ou antipsychotique), le chlorydrate de métoclopramide, dilué dans une solution buvable. Avec tout les dangers que l’on peut imaginer.
Vous ignoriez sans doute que, pour calmer nausées, angoisses et vomissements, vous preniez le risque de déclencher des spasmes du visage et une contraction des mâchoires, des mouvements oculaires anormaux des yeux et des difficultés accrues pour avaler ou pour parler. Sans oublier des crises de torticolis et autres mouvements de la tête échappant au contrôle vigilant du cerveau. Les spécialistes parlent ici de «symptômes extrapyramidaux». Des symptômes très rares, certes impressionnants mais disparaissant sans séquelles après l’arrêt du médicament.
Une molécule de Sanofi-Aventis
Rassurez-vous donc: c’est officiellement fini. En urgence, le Primpéran a été retiré de la vente le 9 février pour les moins de dix-huit ans, c'est à dire ceux à qui il était le plus prescrit —mais nul ne sait encore ce qu’il adviendra des adultes qui ne respecteraient pas, vis-à-vis des plus jeunes, cette nouvelle disposition. La décision a été prise par l’Agence française de sécurité sanitaire des produits de santé (Afssaps) après un demi-siècle ou presque de commercialisation massive par la multinationale française Sanofi-Aventis. Elle vaut pour la traditionnelle forme buvable, ainsi que pour les comprimés sécables et les suppositoires et solutions injectables.
Avec le Primpéran sont retirées les deux versions génériques (métoclopramide Sandoz et métoclopramide Mylan) qui en sont l’exacte duplication. Ces spécialités pharmaceutiques n’étaient disponibles que sur ordonnance médicale et remboursées à 65 % (formes injectables) ou à 35% (autres formes). Depuis le 9 février, les stocks des pharmacies d’officine sont en cours d’identification. Ils seront prochainement rappelés puis, sans doute, détruits.
Les particuliers doivent impérativement rapporter à leur pharmacien les boîtes entamées ou non utilisées. L’Afssaps rappelle d’autre part aux médecins et aux pharmaciens que tout effet indésirable grave ou inattendu doit être déclaré au Centre régional de pharmacovigilance dont ils dépendent.
Il ne traitait pas la cause mais les conséquences
Une déjà bien longue histoire que le Primpéran, commercialisé en France depuis près un demi-siècle. La première description de ses effets antiémétiques date de 1964 et la molécule est tombée dans le domaine public en 1982. Contrairement à ce que l’on pouvait imaginer, administrer cette substance ne traitait pas la cause première des vomissements et des nausées. Cela en réduisait seulement les conséquences en agissant sur certains récepteurs du système nerveux central comme le font les neuroleptiques, médicaments à visée psychiatrique.
Officiellement, c’est parce qu’il présentait un «profil de risque défavorable» avec un «risque augmenté de survenue d'effets neurologiques» chez les jeunes enfants et les adolescents (risque augmentant pour des doses élevées ou répétées) que ce célèbre médicament a été retiré du marché. Mais pourquoi après cinquante ans de commercialisation? Et, faute de disposer des chiffres de pharmacovigilance et de ventes du Primpéran, que signifie précisément un «risque augmenté»?
Selon l’Afssaps, les enfants seraient aujourd’hui «plus exposés à un risque de surdosage, par utilisation de formes adaptées [à l’adulte] ou par des doses administrées supérieures à celles conseillées». Or, c’est précisément pour régler ce problème que plusieurs mesures avaient été prises en France, avec notamment la mise à disposition (depuis octobre 2010) de deux solutions buvables avec pipettes graduées distinctes selon le poids des enfants. Ceci n’aurait donc pas été suffisant.
Usage détourné du principe de précaution
Pour justifier sa décision, l’Afssaps ajoute que «le bénéfice du produit est insuffisamment démontré dans les nausées et vomissements provoquées ou non par les chimiothérapies anticancéreuses». Bigre. On aurait donc laissé sur le marché français, depuis le début des années 1960, un médicament très fréquemment prescrit chez des enfants et dont on aurait à la fois sous-estimé les risques et surestimé l’efficacité. Et ce constat n’aurait finalement été établi qu’au vu d’une «réévaluation du rapport bénéfice/risque», réévaluation que la France souhaite voir désormais organisée dans les différents pays européens.
Où sont les chiffres de cette réévaluation? Est-ce bien sérieux? Si oui, comment comprendre la décision qui en découle? L’affaire du Primpéran s’inscrit plus généralement dans la nouvelle politique de surveillance renforcée des médicaments présents sur le marché, qui découle pour une large part de l’affaire du Mediator.
Elle est aussi en résonance avec un usage totalement détourné du principe de précaution. Après des décennies de grande tolérance de la tutelle vis-à-vis des agissements des géants de l’industrie pharmaceutique, cette nouvelle dynamique était certes devenue indispensable. Mais elle pèche dangereusement par manque de pédagogie, tant vis-à-vis des prescripteurs que des consommateurs. Le cas du Primpéran en est une parfaite illustration, de même que l’avait été en 2009 le retrait du Di-Antalvic, rapidement suivi de celui des nombreux anti-inflammatoires contenant du kétoprofène.
Suspicion sur l’ensemble de la pharmacopée
D’autres suivront. Jusqu’où? Loin de rassurer l’opinion, ces retraits largement inexpliqués de médicaments commercialisés de longue date apparaissent comme incompréhensibles aux yeux du plus grand nombre. Comme on pouvait aisément s’y attendre, ils ont aussi une conséquence paradoxale: celle de jeter la suspicion sur l’ensemble de la pharmacopée existante, et ce sans jamais parvenir à rassurer quant à la pertinence et la nécessité des décisions prises. L’Afssaps apparaît aujourd’hui comme agissant trop souvent à contretemps et son image a été doublement et durablement mise à mal par l’affaire du Mediator puis par celle des prothèses mammaires.
C’est là une situation difficilement acceptable en termes de santé publique. Une situation face à laquelle Xavier Bertrand, actuel ministre de la Santé, s’est durablement révélé —en dépit de ses déclarations récurrentes sur «l’avant-après Médiator» et malgré sa dernière initiative législative sur la sécurité sanitaire du médicament— incapable de fournir des réponses efficaces.
Jean-Yves Nau
SOURCE : Slate.fr